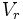شناسایی فسفر در آب
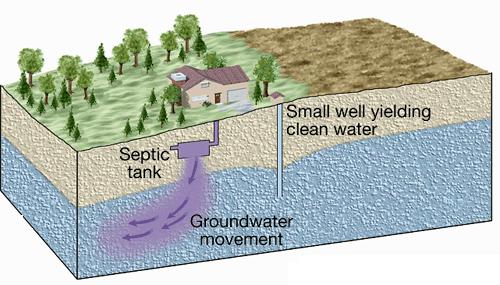
حضور در آب و فاضلاب: فسفر در اکثر آبهای طبيعی و پسابها تقريبأ فقط به صورت فسفات وجو دارد. فسفاتها به سه شکل ارتوفسفاتها، پلی فسفاتها، (پيرو – متا و ديگر پلی فسفاتها) يا فسفات متراکم و فسفاتهای آلی در طبيعت وجود دارند که می توانند بصورت محلول، ذرات ريز و درشت يا در بدن موجودات آبزی يافت شوند. اشکال مختلف فسفاتها از منابع متعددی توليد می شوند. ميزان کمي از برخی پلی فسفاتها طی فرايند های تصفيه به آب افزوده می شوند. مقادير بيشتری از اين ترکيبات ممکن است هنگام شستشو وارد منابع آب شوند زيرا اين مواد از اجزاء اصلی بسياری از پاک کننده های تجارتی هستند. فسفاتها بطور گسترده ای در تصفيه آب ديگهای بخار بکار می روند. ارتو فسفاتهای مصرفی در کشاورزی تحت عنوان کودهای فسفات می توانند به دنبال شسته شدن خاک در اثر سيلابها و ريزشهای تر ويا ذوب برف وارد آبهای سطحی شوند. فسفاتهای آلی اساسأ به وسيله فرايندهای بيولوژکی تشکيل می شوند. اين ترکيبات در اثر ورود فوضولات و باقيمانده مواد غذائی به فاضلاب و همچنين از تبديل ارتو فسفاتها در فرايند تصفيه بيو لوژيکی و يا توسط آبزيان توليد می شوند.
فسفر برای رشد موجودات زنده ضروری است و می تواند ماده مغزی محدود کننده رشد و توليد مثل آبزيان در يک منبع آبی باشد. در جای که فسفات عنصر محدود کننده رشد است، تخليه پسابهای خام يا تصفيه شده، زهاب کشاورزی و يا برخی فاضلابهای صنعتی به منبع آبی می توانند موجب رشد فتوسنتزی آبزيان ريز و درشت ناخواسته و مزاحم گردد. به علاوه فسفاتها در رسوبات ته نشين شده و لجن های بيولوژيکی به شکل مواد معدنی قابل ته نشينی و ترکيب با مواد آلی نيز وجود دارند.
تعاريف
اندازه گيری فسفر شامل دو مرحله است:
الف) تبديل گونه های مختلف فسفر به ارتو فسفات محلول
ب) تعيين ارتو فسفات محلول به روش رنگ سنجی. جداسازی اشکال مختلف فسفر به شيوه تجزيه ايی صورت می گيرد.
صاف کردن نمونه از ميان غشايی 45/0 ميکرون فسفر محلول را از شکل معلق آن جدا می کند ولی تاکنون ثابت نشده که صاف کردن با چنين معانی فسفر معلق و محلول را کاملأ از هم جدا می کند. اين کار شيوه ای آسان و مناسب برای جداسازی کلی مواد محلول و معلق است.
صاف کردن با صافی غشائی به علت احتمال بيشتر جداسازی ذرات ريز نسبت به صافی معمولی ترجيح دارد. به منظور افزايش سرعت صاف شدن می توان از صافی پشم شيشه برای مرحله مقدماتی صاف کردن استفاده نمود.
فسفاتهای که بدون انجام مراحل مقدماتی هيدروليز و يا هضم اکسيدی نمونه به آزمايش های رنگ سنجی پاسخ ميدهند، « فسفر واکنشگر» ناميده می شوند. هر چند که بيشتر فسفر واکنشگر از نوع ارتوفسفات است، اما جزء کوچکی از پلی فسفات های موجود در نمونه نيز در حين کار به طور اجتناب ناپذيری هيدروليز می شود . فسفر واکنشگر به هر دو صورت معلق ومحلول موجود می باشد.
هيدروليز اسيدی در دمای جوش آب، پلی فسفاتها ی محلول ومعلق ريز را به ارتو فسفاتها ی محلول تبديل می کند.فرايند هيدروليز همچنين مقداری فسفات را از ترکيبات آلی آزاد می کند، ولی اين مسئله را می توان با انتخاب مناسب قدرت اسيدی و زمان و دمای هيدروليز به حداقل ممکن کاهش داد. به همين جهت عبارت « فسفر قابل هيدروليز با اسيد» به جای « پلی فسفات » مناسب تر است.
فسفاتهای که تنها به وسيله تجزيه اکسيد اسيونی مواد آلی موجود بود ارتو فسفات تبديل می شود تحت عنوان « فسفر با پيوند آلي» يا « فسفر آلی » خوانده می شود شدت اکسيداسيون لازم برای اين تبديل، به شکل و ميزان فسفر آلی موجود بستگی دارد فسفر آلی مانند فسفر واکنشگر وفسفر قابل هيدروليز اسيدی به هر دو صورت معلق و محلول وجود دارد.
کل فسفر و نيز فسفر محلول و معلق از نظر تجزيه پذيری می توانند به سه شکل شيميايی به اشاره شده تقسيم شوند: فسفر واکنشگر، فسفر قابل هيدروليز اسيدی و فسفر آلی. شکل 1 مراحل انجام آزمايش هر يک از اجزاء فسفر را نشان می دهد. اندازه گيری ها معملأ فقط روی نمونه های صاف شده و صاف نشده انجام می شود و فسفر معلق به وسيله اختلاف اين در تعيين می گردد.
انتخاب روش
الف- روشهای هضم: چون فسفر ممکن است در ترکيب با مواد آلی باشد، يک مرحله هضم برای اکسيداسيون موثر مواد آلی جهت تبديل فسفر به شکل ارتوفسفات بايد به کار گرفته شود. سه روش هضم در بخش های 3 و 4و 5 مبحث آماده سازی نمونه برای آزمايش فسفر تشريح
شده اند. روش اسيد پر کلريک وقت گير درعين حال رقيق است و تنها برای نمونه های پيچيده مثل رسوبات، پيشنهاد می شود.
روش اسيد سولفوريک – اسيد نيتريک برای بيشتر نمونه ها مناسب است. تا به حال ساده ترين روش، شيوه اکسيد اسيون با پرسولفات می باشند. پيشنهاد می شود که اين روش ابتدا در مقابل يک يا چندروش هضم توتير کنترل گشته و پس از کسب کارائی مشخص به کار رود.
پس از هضم، ارتو فسفات آزاد شده به وسيله يکی از روشهای تعيين فسفر اندازه گيری می شود. روش رنگ سنجی نسبت به روش هضم با در نظر گرفتن اثر مزاحمت ها حداقل غلضت قابل تشخيص را تعيين می کند.
ب- روش رنگ سنجی: سه روش برای اندازه گيری ارتو فسفات شرح داده شده است. انتخاب هر يک از آنها بستگی زيادی به دامنه غلضت ارتو فسفات دارد. روش اسيد و انا دوموليبد و فسفر يک برای آزمايشات روزانه در محدوده از 1 تا 20 ميلی گرم در ليتر فسفر بهترين است. روش کلريد قلع يا روش اسيداسکوربيک برای محدوده از 01/0 تا 6 ميلی گرم در ليتر فسفر مناسب تر می باشند. برای مقادير پايين تر در حضور عوامل مداخله گری که بايد حذف شوند يک مرحله استخراج نيز توصيه می شوند. روش اتوماتيک اسيد اسکوربيک نيز وجود دارد.
دقت و صحت: برای کمک به انتخاب روش ، نتايج حاصل از ترکيب روشهای مختلف هضم، هيدر.ليز و رنگ سنجی برای سه نمونه آزمايشگاهی که طرز تهيه آن ها در زير آمده است در جدول 1 نشان داده شده است
نمونه 1:100mg/l ارتوفسفات (po43--p) ، mg/l 80 پلی فسفات (هگزا متا فسفات سديم). mg/l 30 فسفر آلی (اسيد آدنيليک) ، mg/l NH3 –N 5/1 ، mg/l No3- -N 5/0 و mg/l CL-400
نمونه 2:mg/l po43- -p 600، mg/l 300 پلی فسفات (هگزا متا فسفات سديم). mg/l 90 فسفر آلی (اسيد آرنيليک)، mg/l nh3 –n 8/0 ، mg/l No3- 0/5 و CL- mg/l 400 .
نمونه 3 : mg/l pou3- -p 00/7 ، mg/l 00/3 پلی فسفات (هگزا متا فسفات سديم). Mg/l 90 فسفر آلی (اسيد آرنيليک)، mg/l nh3 –n 2/0 ، mg/l No3- 0/5 و cl - mg/l 400
نمونه برداری و نگهداری نمونه ها
در صورتی که قرار باشد شکلهای مختلف فسفر به طور مجزا اندازه گيری شوند.نمونه بايد بلافاصله بعد از جمع آوری صاف گردد. سپس در دمای c10- يا کمتر منجمد و محافظت شود. هنگامی که نمونه ها برای مدت طولانی نگهداری می شوند، mg 40 Hgcl2 به ازاء هر ليتر
نمونه بخ آناضافه می شود.(احتياط: Hgcl2 يک ماده خطراناک است، به هنگام دور ريختن احتياط های لازم را در نظر بگيريد).زمانی که قرار است اشکال مختلف فسفر تعيين شوند، نبايد از اسيد يا کلروفرم بريا حفاظت نمونه استفاده نمود. اگر فقط فسفر کل اندازه گيريی می شود: يک ميلی ليتر HCL تهيه کرده (غليظ ) و به هر ليتر نمونه اضافه کنيد و يا بدون هيچ افزودنی منجمد کنيد.
نمونه های حاوی غلظت های کم فسفر را بجز در حالت انجماد نبايد در بطری های پلاستيکی نگهداری نمود. زيرا صفات می تواند بر ديواره ظرف جذب شود. هم ظروف شيشه ای را می بايست با HCL رقيق و داغ شسته و پس چند باربا آب مقطر آب کشی نمود . هرگز نبايد از پاک کننده های تجارتی حاوی صفات برای تميز کردن شيشه آلاتی که در آزمايش فسفات بکار می رو د استفاده کرد.
آماده سازی نمونه
جهت کسب اطلاعات لازم در ارتباط با انتخاب روش هضم به قسمت های زير توجه کنيد:
1- صاف کردن اوليه
برای تعيين فسفر واکنشگر محلول، فسفر قابل هيدروليز اسيدی محلول و کل فسفر محلول، نمونه را به کمک صافی عشائی صاف کنيد. برای صاف کردن اوليه نمونه هايی که به سختی
صاف می شوند می توان ابتدا از صافی پشم شيشه و سپس از صافی غشائی استفاده کرد.
در نمونه هايی که غلضت فسفات آنها کم است مقاديری فسفر می تواند از طريق صافی غشائی به نمونه راه يابد، به همين جهت توصيه می شود صافيهای غشائی قبل از استفاده با خيساندن در آب مقطر شسته شوند، برای شستشوی صافيها می توان از يکی از دو روش زير کمک گرفت:
الف) خيساندن 50 عدد صافی در 2 ليتر آب مقطر برای مدت 24 ساعت.
ب) خيساندن 50 عدد صافی در 2 ليتر آب مقطر به مدت 1 ساعت . تعويض آب مقطر و خيساندن مجدد به ميزان 3 ساعت.
صافيهای غشايی را می توان با چندين حجم 100 ميلی ليتری آب مقطر نيز شستشو داد. در اين روش جهت اطمينان از شسته شدن کامل صافيها و برای کاهش خطای ناشی از انواع مختلف آنها می بايست از محلول مشاهد کمک گرفت



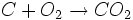
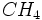 بوی زنندهای دارد و قابل اشتعال است.
بوی زنندهای دارد و قابل اشتعال است. 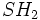 بدبو و بویی نظیر تخم مرغ گندیده دارد و
بدبو و بویی نظیر تخم مرغ گندیده دارد و 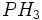 ، سمی خطرناک بوده و بوی تند سیر میدهد. بطور کلی غالب محصولات از فعالیت باکتریهای بی هوازی برای زندگی دیگر موجودات بخصوص موجودات آبزی ، مضر است.
، سمی خطرناک بوده و بوی تند سیر میدهد. بطور کلی غالب محصولات از فعالیت باکتریهای بی هوازی برای زندگی دیگر موجودات بخصوص موجودات آبزی ، مضر است. 
 میباشد و مهمترین کربناتهای آب عبارتند از
میباشد و مهمترین کربناتهای آب عبارتند از  بیکربناتهای مهمی که معمولا در آب وجود دارند عبارتند از
بیکربناتهای مهمی که معمولا در آب وجود دارند عبارتند از 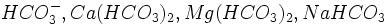 .
. 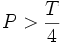 قلیائیت مربوط به هیدروکسیدها و کربناتها میباشد.
قلیائیت مربوط به هیدروکسیدها و کربناتها میباشد.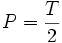 قلیائیت مربوط به کربناتها میباشد.
قلیائیت مربوط به کربناتها میباشد. قلیائیت مربوط به کربناتها و بی کربناتها میباشد.
قلیائیت مربوط به کربناتها و بی کربناتها میباشد.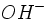 وجود دارند، بیکربناتها وجود ندارند و عموما به کربنات تبدیل شدهاند. از آن رو درصورت موجود بودن قلیائیت هیدروکسید ، مقدار قلیائیت بیکربنات عملا صفر خواهد بود. البته عکس این مطلب هم صادق است.
وجود دارند، بیکربناتها وجود ندارند و عموما به کربنات تبدیل شدهاند. از آن رو درصورت موجود بودن قلیائیت هیدروکسید ، مقدار قلیائیت بیکربنات عملا صفر خواهد بود. البته عکس این مطلب هم صادق است. 
 ،
،  ،
،  ،
، 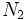 و ترکیب آن با
و ترکیب آن با 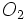 ) تولید میشود و پراکسی الکوکسیل نیترات نیز از ترکیب اکسید ازت با منوکسید کربن و هیدروکربورهای سوخته حاصل میشود. در آب باران ،
) تولید میشود و پراکسی الکوکسیل نیترات نیز از ترکیب اکسید ازت با منوکسید کربن و هیدروکربورهای سوخته حاصل میشود. در آب باران ، 
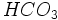 ) در آب خالص است.
) در آب خالص است.
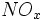 را دربر دارند، بوجود میآیند. از این رو معمولا محل نزول باران اسیدی دورتر از منبع آلایندهها میباشد. باران اسیدی یک مشکل آلودگی است که به علت حمل دوربرد آلایندههای هوا توسط باد حد و مرز جغرافیایی نمیشناسد.
را دربر دارند، بوجود میآیند. از این رو معمولا محل نزول باران اسیدی دورتر از منبع آلایندهها میباشد. باران اسیدی یک مشکل آلودگی است که به علت حمل دوربرد آلایندههای هوا توسط باد حد و مرز جغرافیایی نمیشناسد. 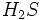 در هوا انتشار مییابد. بیشتر کانیهای با ارزش در طبیعت به صورت سولفید یافت میشود. بنابراین هنگام استخراج و تبدیل آنها به فلز آزاد مقداری
در هوا انتشار مییابد. بیشتر کانیهای با ارزش در طبیعت به صورت سولفید یافت میشود. بنابراین هنگام استخراج و تبدیل آنها به فلز آزاد مقداری 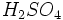 تبدیل میگردد و در اثر کاهش دما در قسمتهای بالای جو به صورت باران اسیدی به زمین برمیگردد.
تبدیل میگردد و در اثر کاهش دما در قسمتهای بالای جو به صورت باران اسیدی به زمین برمیگردد. 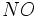 و
و 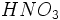 تبدیل شوند که هر دو در آب بسیار انحلال پذیر و جز اسیدهای قوی میباشند. در واقع تمام قدرت اسیدی در باران اسیدی ، به علت وجود این دو اسید است.
تبدیل شوند که هر دو در آب بسیار انحلال پذیر و جز اسیدهای قوی میباشند. در واقع تمام قدرت اسیدی در باران اسیدی ، به علت وجود این دو اسید است.

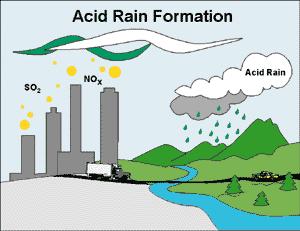

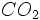 موجود در هوا و یا تجزیه مواد آلی موجود در آب باشد، با وجودیکه مقدار
موجود در هوا و یا تجزیه مواد آلی موجود در آب باشد، با وجودیکه مقدار