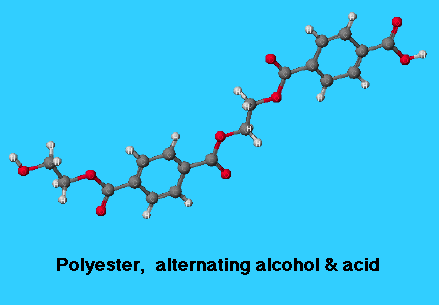
هیدرازین
دید کلی 
هیدرازین به فرمول N۲H۴، در صنعت کاربرد فراوانی دارد. اما همانند هر ماده شیمیایی دیگری، کار با آن مستلزم رعایت اصول ایمنی و آزمایشگاهی است. با برخی از خطرات کار با هیدرازین و چگونگی مقابله با این خطرات آشنا میشویم.
● انفجار و آتش سوزی
مخلوط حاوی بیش از 4.7% حجمی هیدرازین بیآب و هوا میتواند در دماهای بالاتر از ۳۸ درجه سانتیگراد، بر اثر گرما، شعله یا تابش فرابنفش منفجر شود. دمای اشتعال هیدرازین آبدار ۷۵ درجه سانتیگراد است. در مورد محلولهای هیدرازین، خطر انفجار کاهش مییابد و در محلولهای رقیقتر از ۴۰ درصد خطر اشتعال از بین میرود. تماس هیدرازین با فلزات، اکسیدهای فلزی و مواد اکسید کننده، اسیدها، مواد متخلخل نظیر خاک، چوب، کاغذ یا پارچه ممکن است به آتش سوزی یا انفجار منجر شود. در صورت کار با پوشاک و تجهیزات آلوده، محصولات سمی مانند اکسیدهای نیتروژن و آمونیاک بوجود میآید.
● طریقه مقابله
برای جلوگیری از بروز خطرها، هیدرازین بیآب را باید در محیط بسته مجهز به تجهیزات الکتریکی هشدار دهنده مورد استفاده قرار داد. هرگز نباید از هیدرازین در نزدیکی شعله، جرقه و عوامل مشابه استفاده شود. در محل استفاده از هیدرازین، هرگز نباید سیگار استعمال شود. باید از تابش مستقیم نور خورشید و تماس هیدرازین با فلزات و ترکیبهای شیمیایی مانند اکسیدها، بشکههای حاوی هیدرازین را باید با پاشیدن آب خنک کرده، از نشت هیدرازین بیشتر به محیط جلوگیری و همزمان به خاموش کردن آتش اقدام شود. ماموران اطفا حریق باید مجهز به ماسکهای تنفسی، ماسک صورت و پوشش کامل ایمنی باشند. برای خاموش کردن آتشسوزیهای کوچک ناشی از هیدرازین از پاش آب، مواد شیمایی خنک یا گاز CO2 استفاده میشود. در مورد آتش سوزیهای بزرگ باید از کف الکل یا آب با فشار زیاد استفاده شود.
حمل و نقل و ذخیره سازی هیدرازین
هیدرازین را باید در بشکه های محکم دربسته و در جو خنثی نگهداری کرد. محل نگهداری بشکهها باید مجهز به سیستم تهویه، فاضلاب مطمئن، دور از تابش مستقیم نور خورشید و دیگر منابع انرژی باشد. باید از وجود فلزات، اکسیدهای فلزی، مواد متخلخل در این محل اجتناب و برای جلوگری از جرقههای الکتریکی ناشی از الکتریسیته ساکن، مخازن نگهداری هیدرازین را به زمین منتقل کرد. طبق مقررات بینالمللی موجود، هیدرازین آبدار و محلولهای آبی آن باید در مخازن فلزی با پوشش داخلی پلی اتیلنی، قوطیهای پلاستیک یا مخازن استیل ضد زنگ حمل شوند.
● دفع ضایعات هیدرازین
باید کلیه منابع احتمالی ایجاد احتراق را از محیط دور و مایع نشت شده را جمع آوری کرد. در صورتیکه هیدرازین روی سطح زمین یا محل نگهداری ریخته شده باشد، آن را با آب تا غلظت کمتر از ۴۰ درصد رقیق میکنند و روی ناحیه ناحیه مزبور را کف میپاشند تا هیدرازین تبخیر نشود. برای جمع آوری مقادیر کم هیدرازین از شن و ماسه استفاده میشود. افراد مسئول نظافت باید مجهز به تجهیزات کامل ایمنی از جمله ماسک و لباسهای محافظ باشند و پس از رقیق کردن هیدرازین تا محلول کمتر از ۴۰% میتوان آنرا با محلول رقیق سولفوریک اسید خنثی و به همراه مقادیر زیادی آب به محیط زیست وارد کرد. بقایای هیدرازین را میتوان پس از رقیق کردن با الکل در یک زباله سوز شیمیایی مجهز به سیستم جذب گازهای مضر دودکش بوسیله سوختهای هیدروکربنی سوزاند و از بین برد.

اثرات مضر هیدرازین بر روی انسان
با وجود استفاده های صنعتی گسترده از هیدرازین، مطالعات مدون کمی درباره اثرات مضر آن در انسان انجام گرفته است. انسان ممکن است از راههای مختلفی از جمله شغلی، مصرف داروهای حاوی هیدرازین، مصرف سیگار یا به صورت تصادفی در معرض هیدرازین قرار گیرد. هیدرازین از طریق پوست، ریه و دستگاه گوارش جذب و به سرعت در سراسر بدن پخش میشود. در مورد مسمومیتهای حاد انسان، استفراغ، آسیبهای متعدد دستگاه تنفسی، سیستم اعصاب مرکزی کبد و کلیهها گزارش شده است. با این همه گزارشهای موجود از مسمومیتهای حاد خوراکی با هیدرازین روشن میکند که خوردن حدود ۲۰ تا ۵۰ میلیلیتر هیدرازین ممکن است مرگ آور باشد. اغلب اثرات مشاهده شده در افرادی که در معرض هیدرازین قرار گرفتهاند، در حیوانات آزمایشگاهی نیز دیده شده است. علاوه بر اثرات فوق، کاهش وزن بدن، کمخونی، کاهش قند خون و چربی کبد نیز در برخی موارد مشاهده شده است. سمیت هیدرازین نسبت به جنین و جوانه برخی حیوانات آزمایشگاهی و گیاهان به اثبات رسیده است، ولی اطلاعاتی در مورد سمیت هیدرازین بر جنین انسان وجود ندارد. سوزش پوست و چشم در انسان بر اثر تماس با هیدرازین مشاهده شده است، ولی اطلاعات کافی برای بیان بدون اثرات سوزش آور وجود ندارد. هیدرازین حساسیت زای قوی برای پوست انسان بوده، با مشتقات خود تداخل میکند. هیدرازرین در مطالعات خارج از محیط زنده بدن در برخی از گیاهان، باکتریها، قارچها و سلولهای *****داران، جهش ژنی و انحرافات کروموزومی ایجاد میکند. سرطانزایی هیدرازین در جانوران آزمایشگاهی به اثبات رسیده است، ولی در مورد انسان، دادههای کافی برای چنین ادعایی وجود ندارد. در غیاب چنین دادههایی و با در نظر گرفتن اطلاعات موجود در مورد جهش زایی و سرطانزایی هیدرازین در حیوانات، هیدرازین از سوی موسسه بین المللی سرطان، به عنوان یک ماده سرطانزا برای انسان معرفی شده است. بدین ترتیب باید قرار گرفتن انسان در معرض هیدرازین به حداقل ممکن کاهش داده شود.







 گرم چای را در یک بشر یک لیتری ریخته با 500 میلی لیتر آب حدود 25 دقیقه بجوشانید. در یک بشر دیگر به وسیله پارچه آنرا صاف کنید و در همان حال ظرف محلول صاف شده باید روی اجاق باشد تا محلول سرد نشود. همراه با به همزدن 150 میلی لیتر محلول 10% بازی استات سرب به آن اضافه کنید. تانین رسوب میکند. محلول گرم را صاف کنید. محلول را با اسید سولفوریک رقیق واکنش دهید تا سولفات سرب رسوب کند. رسوب را صاف کنید. به محلول 5 گرم کربن اکتیو اضافه کنید و حرارت دهید تا حجم آن حدود 200 – 150 میلی لیتر بشود. محلول را صاف کنید و با 25 میلی لیتر کلروفرم تکان دهید. لایه کلروفرم را در قیف جدا کننده جدا کنید. استخراج با 25 میلی لیتر کلروفرم را 3 مرتبه انجام دهید. به وسیله تقطیر، بیشتر کلروفرم را خارج کنید. باقی مانده را در مقدار کمی آب گرم حل کنید و محلول را با تبخیر آهسته فشرده کنید. کافئین مانند رشته های ابریشم جدا میشود. محصول کافئین با یک مولکول آب همراه است که اگر تا 100 درجه سانتیگراد آنرا گرم کنید آبش را از دست میدهد. راندمان و نقطه ذوب آنرا تعیین کنید.
گرم چای را در یک بشر یک لیتری ریخته با 500 میلی لیتر آب حدود 25 دقیقه بجوشانید. در یک بشر دیگر به وسیله پارچه آنرا صاف کنید و در همان حال ظرف محلول صاف شده باید روی اجاق باشد تا محلول سرد نشود. همراه با به همزدن 150 میلی لیتر محلول 10% بازی استات سرب به آن اضافه کنید. تانین رسوب میکند. محلول گرم را صاف کنید. محلول را با اسید سولفوریک رقیق واکنش دهید تا سولفات سرب رسوب کند. رسوب را صاف کنید. به محلول 5 گرم کربن اکتیو اضافه کنید و حرارت دهید تا حجم آن حدود 200 – 150 میلی لیتر بشود. محلول را صاف کنید و با 25 میلی لیتر کلروفرم تکان دهید. لایه کلروفرم را در قیف جدا کننده جدا کنید. استخراج با 25 میلی لیتر کلروفرم را 3 مرتبه انجام دهید. به وسیله تقطیر، بیشتر کلروفرم را خارج کنید. باقی مانده را در مقدار کمی آب گرم حل کنید و محلول را با تبخیر آهسته فشرده کنید. کافئین مانند رشته های ابریشم جدا میشود. محصول کافئین با یک مولکول آب همراه است که اگر تا 100 درجه سانتیگراد آنرا گرم کنید آبش را از دست میدهد. راندمان و نقطه ذوب آنرا تعیین کنید.