شیمی تابش
شیمی تابش
اطلاعات اولیه 
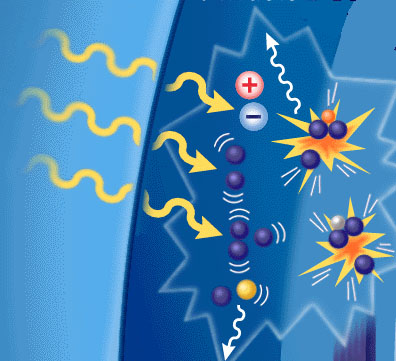
فوتونی پرانرژی که به یک سیستم جذب کننده وارد میشود، در یک تک مرحله به مولکولهای زیستی مهم ، آسیب ناشی از یونش وارد نمیآورد. در هر حالت ، فوتون ، دستخوش رویدادهای پراکندگی قرار میگیرد که به تولید الکترونهای پرانرژی میانجامد که سرانجام در گونههای مولکولی انرژی را رسوب میدهد. انرژی جنبشی این الکترونها عموما در گستره کیلو و مگا الکترون ولت است و برای اینکه آسیب ناشی از یونش در مولکولهای زیستی مهم موثر باشد، این الکترونها باید از رویدادهای انتقال انرژی ، حدود دهها الکترون ولت متاثر شوند.
برهمکنش تابش با مولکولها در محیط جذب کننده از طریق فوتون اولیه صورت نمیگیرد، بلکه بیشتر از طریق انتقال از ذرات باردار با انرژی جنبشی زیاد است که بر اثر فرآیندهای پراکندگی بوجود آمدهاند. انرژی جذب شده در مولکول محیط ، میتواند به پرتاب یک یا چند الکترون از مولکول بیانجامد که به ایجاد یک زوج یون یا یونش مولکول هدف منجر شود. انرژی جذب شده ممکن است به بالا بردن الکترونها از حالت پایه به حالت برانگیخته بیانجامد، فرآیندی که برانگیزش نام دارد. مولکولها در حالت برانگیخته بسیار ناپایدارند.
فرآوردههای اولیه رادیولیز آب
آب ، بخش بزرگی از محیط موجودات زنده را تشکیل میدهد و عجیب نیست که برای موجودات زنده ، مقدار چشمگیری از انتقال انرژی با این مولکول انجام میشود. اثر مستقیم برانگیزشها و یونشهای ناشی از الکترون ثانویه ، واکنش غالب در موجودات زنده برای تابش با LET (انتقال خطی انرژی) پایین به شمار میآید. نتیجه نهایی این شیمی تابش اولیه برانگیزش و یونش در یک آبدار که در یک مقیاس زمانی12-10 _ 16-10 ثانیه روی میدهد، عبارتند از: فرآوردههای شامل H2O و فرآوردههای ناشی از تجزیه آن
واکنش رادیکالهای آب با گیرنده آن
واکنش رادیکالهای آب یا آب ، به خودی خود ، فرآیند جالبی است، اما برای بدست آوردن یک نتیجه زیست شناختی ناشی از رویداد تابش ، باید یک برهمکنش شیمیایی از گونه واکنشی یا مولکولهای زیستی موجود باشد تا سرانجام به تداخلی در عملکرد یاختهای طبیعی منجر شود. شیمیدانهای تابش ، عبارت رباینده را برای انواع مواد شیمیایی بکار میبرند که با رادیکالها و سایر صورتهای فعال موجود در آب پرتو گرفته ، بر همکنش برقرار کنند.
رباینده که میتواند هر نوع مولکول قادر به بر همکنش باشد، با رادیکالها واکنش انجام میدهد تا شیمی آب را به سرانجامی برساند. نکته جالب این است که برای غلظتهای پایین هر مولکول رباینده ، کسری از رادیکالها که با رباینده برهمکنش انجام میدهد. تقریبا در گستره وسیعی از غلظت ربایندهها ، ثابت است.
کنش مستقیم و غیر مستقیم
آب با آثار ممکن بر سیستمهای زیستی ، رابطه دارد. علاوه بر واکنش پذیری فرآوردههای رادیولیز آب که سبب میشود با مولکولهای زیستی مهم موجود در یاخته برهمکنش انجام دهند، این امکان هم وجود دارد که انرژی ذخیره شده توسط الکترون با انرژی جنبشی بالا مستقیما در مولکول زیستی مورد نظر ، ذخیره شود. در آن مورد واکنشهای فیزیکی - شیمیایی بیشتر در مولکولهای اجزای تشکیل دهنده مهم مانند DNA صورت میگیرد تا در آب ، نتیجه یونش و یا برانگیزش در اتمهای این مولکولها و تشکیل رادیکال از این مولکول زیستی حائز اهمیت است.
کنش مستقیم
برای این فرآیند ، انرژی مستقیما در مولکول هدف که دارای اهمیت زیستی است، بدون دخالت انواع رادیکالی حاصل از رادیولیز آب انباشته میشود. رابطه دوز - پاخ عموما لگاریتمی - خطی است، بطوری که در قالب رابطه زیر بیان میشود. 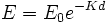 که در آن
که در آن  تعداد آغازگر مولکولهای دست نخورده بوده ،
تعداد آغازگر مولکولهای دست نخورده بوده ، 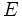 تعداد باقیمانده پس از دوز
تعداد باقیمانده پس از دوز 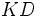 مقداری ثابت است.
مقداری ثابت است.
این رابطه بر این فرض استوار است که یک تک رویداد یونش یا برانگیزش در مولکولهای زیستی به تغییری خواهد انجامید که منجر به اتلاف فعالیت زیستی در مولکول میانجامد.
کنش غیر مستقیم
کنش غیر مستقیم ، عبارت است از حاصل کنش فرآوردههای رادیولیتی آب بر هدف که از اهمیت زیستی ناشی میشود. مشخصه مهم کنش مستقیم از این قرار است که آسیب وارده از جانب این سازوکار ، عبارت است از آسیبی که تنها وقتی میتواند حادث شود که انواع رادیکال تولید شده از طریق رادیولیز آب به مولکولهای مهم زیستی ، برسند و با آنها برهمکنش برقرار نمایند.
بنابراین فرآیند ، معمولا از لحاظ پخش یا انتشار محدود میشود و غالبا رابطه دوز - پاسخ پیچیده خواهد بود. اثر غیر مستقیم به صراحت به صورت برهمکنش مولکولهای جسم حل شده و انواع واکنش پذیر مولکولهای حلال تعریف میشود که از طریق کنش مستقیم تابش بر حلال تشکیل خواهد شد. چون آب ، حلال عمده سیستمهای حیاتی است، اکثر کنشهای غیر مستقیم نتیجه انواع واکنش پذیر تشکیل شده از مولکولهای آب خواهد بود.
بازترکیب ، استرداد و ترمیم
بازگرداندن مولکولها به حالت قبل از پرتو گیری از طریق سه ساز و کار ممکن است: بازترکیب ، استرداد و ترمیم.
بازترکیب
بازترکیب میتواند در مراحل بسیار اولیه پس از رویداد پرتو گیری تحقق پذیرد، ضمن اینکه گونههای ناشی از رادیولیز آب تولید شده هنوز بسیار به یکدیگر نزدیک هستند. مقیاس زمانی برای بازترکیب کوتاهتر از 11- 10 ثانیه است. بازترکیب به سادگی به هم نزدیک شدن زوج یونها یا زوج رادیکالها برای تشکیل شدن مولکولی است که از آنها ناشی شدهاند.
استرداد
عبارت است از بازگشت شیمیایی مولکول تغییر یافته به حالت اولیهاش بدون دخالت مراحل آنزیمی یا مراحل کاتالیستی زیستی دیگر. مقیاس زمانی برای استرداد ، یک چهارم ثانیه یا کمتر است. استرداد شیمیایی میتواند به چندین طریق پیشروی کند که بعضی از آنها به خوبی فهمیده نشده است. مثالی برای فهم این فرآیند مفید خواهد بود.
- مثالی در مورد استرداد: فرض کنید که در نتیجه کنش مستقیم و غیر مستقیم ، DNA دستخوش یک رویداد شیمیایی شده است که یک رادیکال را در محلی از مولکول باقی میگذارد. این رادیکال به نوبه خود میتواند دستخوش واکنشی شود که آسیب را به نحوی کم و بیش دائم تثبیت کند (مثلا واکنش با اکسیژن) ، یا ممکن است با یک مولکول دیگر در واکنش مبادله رادیکال ، واکنشی را برقرار کند که مولکول DNA را به حالت قبل از پرتو گیری بازگرداند و یک رادیکال دیگر ، تولید شود. یک مثال نوعی از فرآیند اخیر میتواند برهمکنش رادیکال DNA با مولکولی که دارای سولفیدریل باشد، انجام گیرد که منجر به بازگشت مولکول DNA و تبدیل مولکول سولفیدریل به یک ترکیب رادیکالی باشد.
ترمیم
در یک مقیاس زمانی طولانیتر ، ممکن است ترمیم آنزیمی روی دهد. مقیاس زمانی برای این فرآیند چند دقیقه تا چند ساعت میباشد.
هدف بزرگ مولکولی در یاخته
هدف اساسی برای تبدیل شیمیایی ناشی از القای تابش یونساز که این تغییرات میتوانند از لحاظ زیستی برای زنده ماندن سلول مهم باشد، هم اکنون فهمیده شده است که DNA است. این مولکول اطلاعات ژنومی لازم برای خود تکثیری و نوسازی زیست شیمیایی در یاخته و تقسیم یاختهای را با خود حمل میکند. قسمتی از آسیب القا شده توسط تابش ، نتیجه کنش غیر مستقیم فرآوردههای رادیولیز آب است. قسمتی از آن حاصل کنش مستقیم روی مولکول DNA است. ضمن اینکه DNA هدف عمده به شمار میآید.
روشن است که مولکولهای فعال زیستی دیگر موجود در یاخته نیز دستخوش غیر فعال سازی ناشی از آسیب تابشی مستقیم و غیر مستقیم میشوند. یاخته میتواند از دست دادنهای بسیار بزرگ را در فعالیت زیستی اکثر بیومولکولها ، جز DNA را بدون وارد آوردن نقص جدی به کارهایش ، تحمل کند. مثلا آنزیمها پیوسته ساخته میشوند و مولکولهای آسیب دیده مرتبا جایگزین میشوند.
شواهد موجود برای DNA به عنوان مولکول هدف
- برای موجودات زنده سادهتر مانند باکتری خوار و ویروسها ، میتوان یک رابطه کمی بین آسیب وارد به DNA و کارکرد زیستی برقرار کرد.
- برای موجودات زنده عالیتر ، از دست رفتن کارکرد باگمستت تکرشتهای و یا دو رشتهای ، همبستگی دارد.
- ترمیم آسیب وارد بر DNA در بسیاری از موجودات زنده رابطه تنگاتنگی با زنده ماندن یاخته دارد که از طریق توانایی یاخته برای تقسیم شدن ، سنجیده میشود.
- یاختههایی که فاقد توانایی ترمیم DNA ناشی از تغییر ژنتیکی هستند، به مراتب نسبت به پرتو گیری حساستر از یاختههای طبیعی هستند.
- عوامل شیمیایی که معلوم شده است، مانع ترمیم آسیب وارد بر DNA میشوند، حساسیت یاختهها را نسبت به پرتو گیری ، افزایش میدهند.
- کنشهای مستقیم تابش یوننده بر DNA و سایر مولکولهای زیستی فعال در یاخته به سهولت به صورت گسیختگی پیوند یا تشکیل رادیکال در محل نهشت انرژی تجسم مییابد، که به غیر فعال شدن مولکول هدف میانجامد. کنشهای غیر مستقیم از طریق فرآوردههای تجزیه تابشی پیچیدهتر هستند.
-
آسیبهای وارده بر DNA در اثر رادیکالها
- گروههای کارکردی در پورینها ممکن است بطور برگشت ناپذیری تغییر کنند تا به حضور یک نوکلئوتید نادرست منجر شود.
- آسیب وارد آمده به پورینها و پریمیدینها ممکن است چنان زیاد باشد که به از دست رفتن آنها در مولکول DNA منجر شود.
- یکی از ساز و کارهای انتقال رادیکال معلوم است که تشکیل شده در مکان بازها به ستون قند - فسفات منتقل شده و منجر به اتلاف باز و قطع زنجیره شود.
- وارد آمدن آسیب به محور اصلی دی اکسی ریبوز - فسفات DNA ممکن است سبب قطع این محور اصی و منجر به گسست یک تک رشته شود. وارد آمدن این آسیب بسیار مهم را گسست تک رشتهای (SSB) مینامند.
- وارد آمدن آسیب به محور اصلی دیاکسی ریبوز - فسفات در دو یا چند نقطه مجاور ممکن است به گسیختگی مولکول منجر شود و این آسیب را گسست دو رشته (DSB) مینامند.
گسیختگی زنجیره در DNA
گسیختگی زنجیره تک رشتهای از مولکول DNA برای یاخته ، رویداد چندان خطرناکی نیست زیرا فرآیندهای ترمیم در سلولهای بازده بالایی هستند. عقیده همگان بر این است که گسستهای تک رشتهای در یک یاخته رویداد شایع است، خواه با تابش و خواه بدون تابش و ترمیم آن بسیار کارآمد است. گسستهای دو رشته ای DSB) DNA) برای یاخته دارای عواقب جدی تری هستند. DSB ، یک فرآیند مستعد خطا هستند که اغلب به جهش در ژنوم و یا از دست رفتن ظرفیت تولید مثل ، منجر میشوند. - گروههای کارکردی در پورینها ممکن است بطور برگشت ناپذیری تغییر کنند تا به حضور یک نوکلئوتید نادرست منجر شود.




 ).
).
 ) نیز بیش از یک قرن است که شناخته شده است.
) نیز بیش از یک قرن است که شناخته شده است. ) پس از چندین روز نگهداری در دمای 500 درجه سانتیگراد بلا تغییر میماند، در حالی که
) پس از چندین روز نگهداری در دمای 500 درجه سانتیگراد بلا تغییر میماند، در حالی که  ) در دمای اطاق سریعا تجزیه میشود.
) در دمای اطاق سریعا تجزیه میشود.  ،
،  ،
،  به خودی خود در هوا آتش میگیرند. همچنین بیشتر مشتقات
به خودی خود در هوا آتش میگیرند. همچنین بیشتر مشتقات  ) حمله مولکولهای آب بطور سریع انجام میگیرد، در صورتی که
) حمله مولکولهای آب بطور سریع انجام میگیرد، در صورتی که  در دمای اطاق با وجود داشتن یک اوربیتال خالی 2P در اتم
در دمای اطاق با وجود داشتن یک اوربیتال خالی 2P در اتم  .
. 




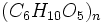 است. تعداد n غالبا بیشتر از هزار است. نشاسته در محیط مرطوب ،
است. تعداد n غالبا بیشتر از هزار است. نشاسته در محیط مرطوب ، 
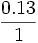 تا
تا  تغییر میکند. قسمت غیر چرب گوشت شامل
تغییر میکند. قسمت غیر چرب گوشت شامل 